
Reaksi berikut yang menunjukkan ionisasi asam fosfat adal...
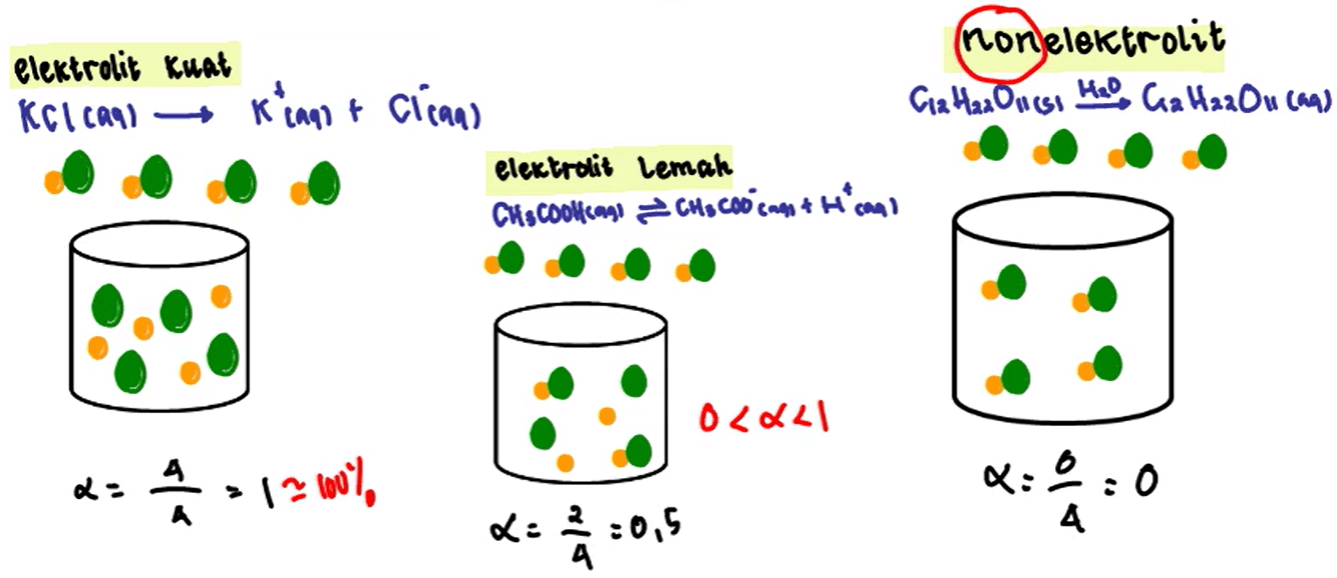
Tingkat ionisasi dilambangkan sebagai α. Kita dapat mengekspresikan derajat ionisasi dengan dua cara, menggunakan skala dari 0-1 (nilainya antara 0 dan 1) dan persentase. Rumus untuk nilai ɑ dapat ditampilkan sebagai berikut: Ɑ = jumlah zat terionisasi / jumlah zat asli dengan rumus. Nilai ɑ terletak pada skala dari 0 hingga 1.

Persamaan reaksi ionisasi yang benar apabila suatu elektr...
0,02 = jumlah mol zat terurai / 0,02 jumlah mol zat terurai = 0,02 x 0,02 = 0,0004 Massa zat terurai = n × Mr = 0,0004 × 60 = 0,024 g. 2. Suatu senyawa X sebanyak 50 gram dilarutkan ke dalam air dan 20 gram senyawa tersebut mengalami ionisasi. Derajat ionisasi senyawa X adalah.. Jawab: 0,4. Berikut materi tentang rumus derajat ionisasi.

Konstanta Ionisasi Asam Lemah YouTube
Berdasar proses pembentukan ion-ionnya (ionisasi), larutan elektrolit memiliki dibagi menjadi 2 jenis, yaitu larutan elektrolit kuat dan larutan elektrolit lemah.. Rumus derajat ionisasi. Dimana, 𝛂 = derajat ionisasi. Dengan ketentuan sebagai berikut, 𝛂=1, maka zat mengalami ionisasi sempurna, atau dapat digolongkan asam atau basa kuat.

Diskusi Kelompok 4 Reaksi Ionisasi, Rumus Molekul dan Tatanama Senyawa YouTube
Secara matematis rumus derajat ionisasi molekul terionisasi α = ————————- molekul mula-mula. Nilai α bergerak diantara nol dan (0< α < 1). Semakin besar α (derajat ionisasi) maka akan semakin besar proporsi jumlah molekul yang terionisasi. Faktanya kalau dihitung benar-benar tidak ada zat atau senyawa yang punya nilai α 0.

Reaksi Ionisasi Dari Caco3 Materi Soal
Berikut kami sajikan contoh asam kuat, asam lemah, basa kuat, basa lemah beserta rumus dan reaksi Ionisasinya. 7 Contoh asam kuat beserta rumus dan reaksi Ionisasinya. 1. Asam Klorida (HCl) Reaksi ionisasi: HCl → H+ + Cl- 2. Asam Nitrat (HNO3) Reaksi ionisasi : HNO3 → H+ + NO3- 3. Asam Sulfat (H2SO4) Reaksi ionisasi:

Reaksi ionisasi asam berikut yang benar berdasarkan defin...
Untuk menghitung besarnya derajat ionisasi dari suatu larutan elektrolit lemah, kita dapat menggunakan rumus berikut: Derajat Ionisasi = (akar kuadrat dari K x C) / C0 x 100%. di mana: - K adalah konstanta kesetimbangan ionisasi. - C adalah konsentrasi ion hasil ionisasi. - C0 adalah konsentrasi awal zat yang dilarutkan.
Pengertian Ionisasi, Disosiasi Dan Eksitasi Beserta Contohnya
1. Terdapat unsur-unsur AA, AB, AC, AD, AE yang berada pada satu golongan unsur. Diketahui besar energi potensial ionisasi sebesar 56 kJ/mol, 183 kJ/mol, 118 kJ/mol, 254 kJ/mol, dan 63 kJ/mol secara berturut-turut. Tentukan urutan yang sesuai dengan kenaikan nomor atom dari unsur-unsur tersebut!
Contoh Soal Energi Ionisasi bukubelajarstate
Rumus dan cara mudah Mencari derajat ionisasi pada basa lemah NH4OH jika diketahui massa, Mr, kb pada soal. Asam basa. Kimia sma. Belajar.

Rumus Derajat Ionisasi Kimia Sma Bit CDN
Energi Ionisasi Relatif = Energi Ionisasi Unsur A / Energi Ionisasi Unsur B. Dalam rumus di atas, EI Unsur A dan Unsur B mewakili EI masing-masing unsur yang dibandingkan. Perlu diingat bahwa EI tidak selalu dapat dihitung dengan rumus matematis, karena energi ionisasi tergantung pada berbagai faktor seperti struktur elektronik, muatan nuklir.

Konsep Mudah Menentukan Reaksi Ionisasi Kimia SMA YouTube
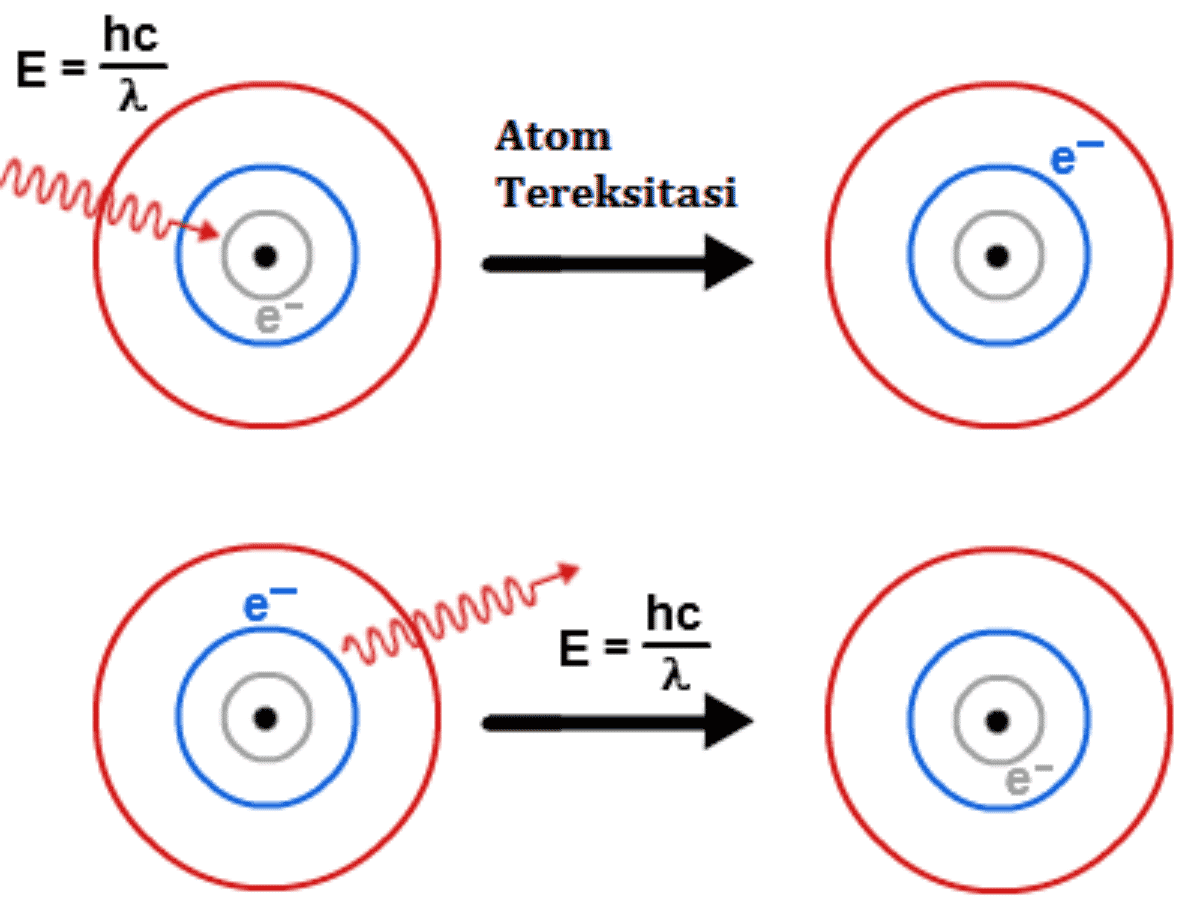
Reaksi ionisasi atau proses ionisasi adalah suatu proses perubahan atom atau kelompok atom netral menjadi atom bermuatan listrik (ion) akibat dari penambahan atau pengurangan elektron dari atom tersebut. Jika suatu atom menangkap sejumlah elektron dari atom lain maka atom tersebut akan bermuatan negative (ion negative = anion).Namun apabila atom tersebut melepaskan sejumlah elektron yang.

Contoh Soal Derajat Ionisasi Sifat Koligatif Larutan Berbagi Contoh Soal
Derajat ionisasi antara 0 < ɑ < atau = 1. Derajat ionisasi ɑ = 0 atau tidak bisa terionisasi. Jika diuji daya listrik akan menghasilkan banyak gelembung gas dan membuat lampu menyala. Tidak bisa digunakan untuk menyalakan lampu dan tidak akan menghasilkan gelembung gas pada elektroda. Merupakan penghantar listrik yang baik.

LENGKAP ‼️ PEMBENTUKAN SENYAWA ION DARI KATION DAN ANION ‼️ KIMIA KELAS 10 YouTube
Dalam kimia, ada sebuah istilah yang disebut ionisasi. Contohnya adalah larutan asam dan basa. Menurut Arrhenius, ionisasi asam menghasilkan ion hidrogen, sedangkan ionisasi basa menghasilkan hidroksida. ADVERTISEMENT. Tingkat keasaman larutan dinyatakan dengan derajat keasaman (pH), yang ditentukan dari negatif logaritma molaritas ion hidrogen.
Rumus Derajat Ionisasi & Contoh Soal Materi Kimia Kelas 10 115
Untuk mencari tetapan ionisasi dari senyawa hidroksilamin tersebut, kita bisa menggunakan rumus yang telah kita buat sebelumnya yaitu : Kb = ( Konsentrasi ion OH- )⋀2 / Konsentrasi Basa Lemah ( M ) Ket : ⋀ = pangkat. Konsentrasi ion OH- dari hidroksilamin bisa kita dapatkan dari PH nya dengan cara : = PH = 14 - pOH. = 11,25 = 14 - pOH.

Perhatikan grafik hubungan antara energi ionisasi dengan
Belajar Modul, Rumus, & Soal Ikatan Ionik dan kuis interaktif.. Diketahui suatu unsur X memiliki nilai energi ionisasi bertingkat berikut: Tentukan dengan unsur dari golongan berapa ia mampu membentuk ikatan ion yang ekuimolar! Jawaban Ekuimolar artinya: membentuk senyawa dengan perbandingan jumlah unsur 1 :.

Reaksi ionisasi Belajar menyetarakan reaksi ionisasi YouTube
Energi ionisasi (IE) adalah energi yang diperlukan untuk mengeluarkan elektron dari tiap mol spesies dalam keadaan gas. Energi untuk mengeluarkan satu elektron pertama (dari atom netralnya) disebut sebagai energi ionisasi pertama dan untuk mengeluarkan satu elektron ke dua disebut energi ionisasi kedua, dan begitu seterusnya untuk pengeluaran.
Raycall Arditama SIFAT KEPERIODIKAN ( ENERGI IONISASI )
Cara Menghitung Energi Ionisasi Cara menentukan energi ionisasi dapat dilakukan menggunakan Model Atom Bohr. Model tersebut akan memprediksi beberapa jalur bagi elektron pada saat mengelilingi inti yang mengandung proton dan neutron. Rumus energi ionisasi dengan model Bohr dapat dituliskan sebagai berikut: En = - 2π² Me⁴/4πϵ₀ Z²/N²