Soal Reaksi Redoks Kelas X Semester 2
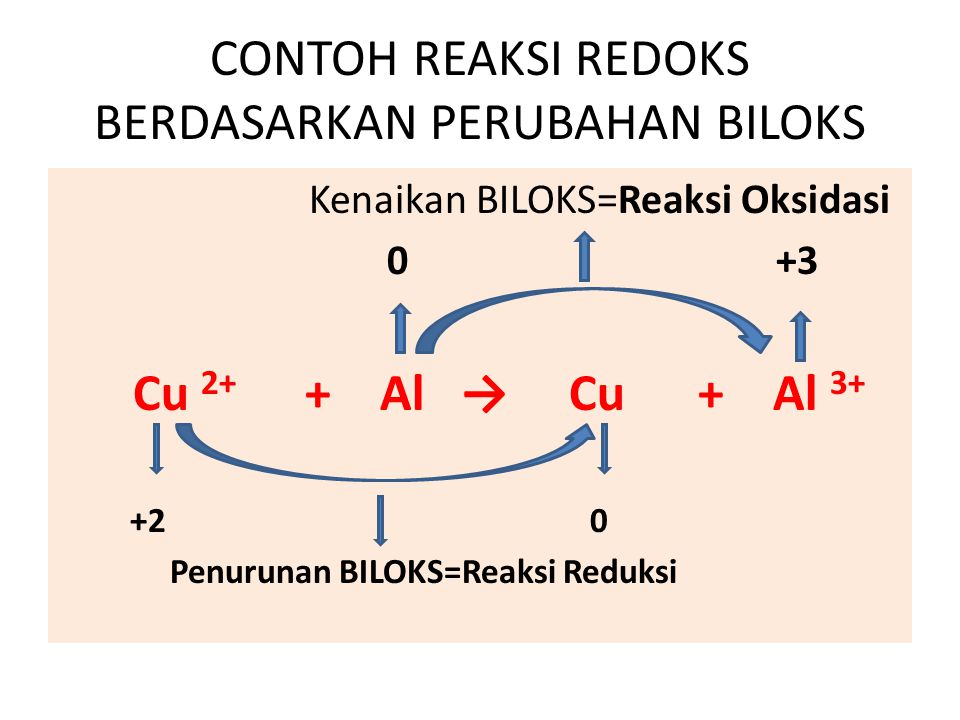
Reaksi redoks dapat dibedakan berdasarkan perubahan bilangan oksidasi, sehigga untuk menentukan spesi yang mengalami reduksi dan oksidasi, perlu diketahui nilai biloksnya. Penentuan Bilangan Oksidasi Penentuan bilangan oksidasi dapat dilakukan dengan mengikuti aturan berikut [3, 4].

Gas Klorin Dapat Dibuat Melalui Reaksi Redoks Berikut
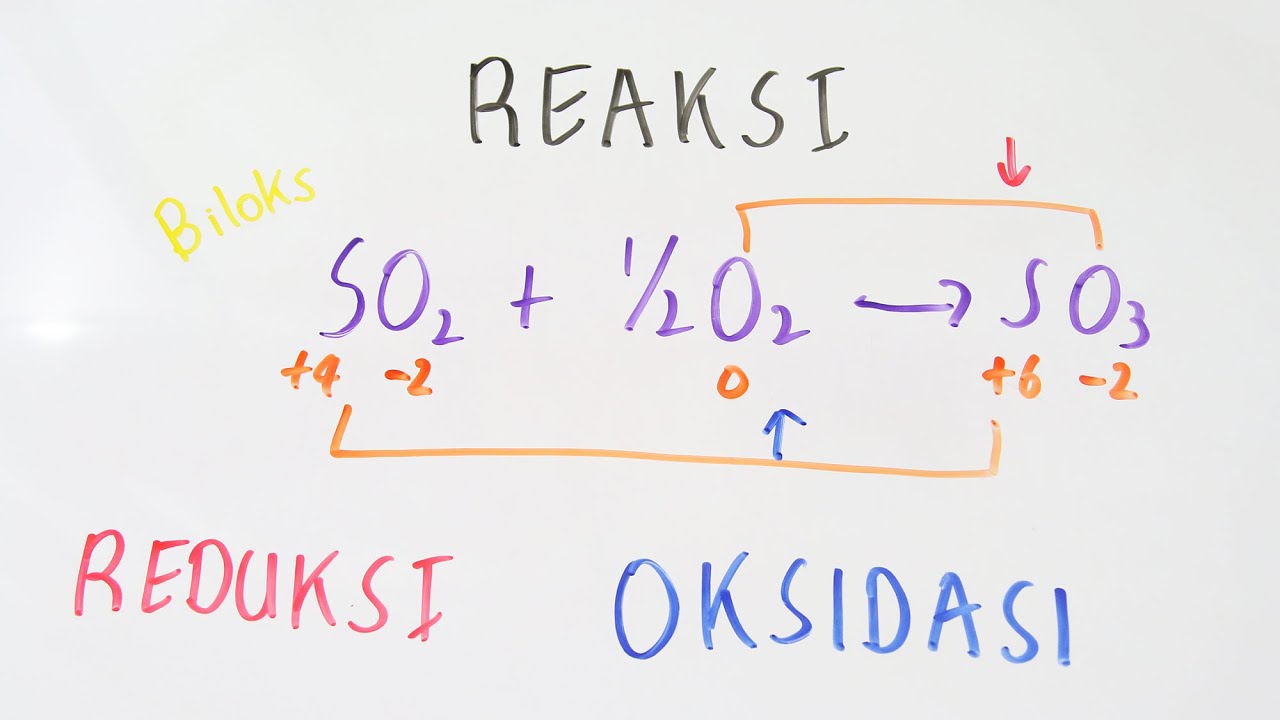
Berdasarkan penangkapan atau pelepasan oksigen. Oksidasi: reaksi yang melibatkan penangkapan atom oksigen. Contoh: C+ O2 → CO2. Atom C (karbon) mengalami oksidasi karena dalam reaksi atom karbon mengikat atom oksigen menjadi CO2. Reduksi: reaksi yang melibatkan pelepasan atom oksigen. Contoh: H2O2 → H2O + O2.

Diketahui reaksi redoks setara berikut; 3As + 5NO3^ + 4O...
Selain tentang redoks, juga tentang elektrokimia. Silakan bisa kamu pelajari soal un redoks dan pembahasannya ini secara mandiri. Jika ada pertanyaan mengenai soal UN redoks dan elektrokimia bisa ditanyakan melalui kolom komentar. Soal UN Redoks dan Elektrokimia Tahun 2013 dan Pembahasannya. Diketahui beberapa persamaan reaksi berikut:

Diketahui reaksi redoks berikut. Br2 (l) + KOH (aq...
Oke, kita lanjut ya bahasannya! Pada reaksi redoks, terdapat unsur-unsur yang bertindak sebagai reduktor dan oksidator. Zat yang mengalami oksidasi itu disebut reduktor, sedangkan zat yang mengalami reduksi disebut oksidator. Coba perhatikan contoh berikut ini, ya! Reaksi: Mg(s) + 2HCl -----> MgCl2(aq) + H2(g) Karena Mg merupakan unsur bebas, jadi biloks Mg = 0.

Diketahui suatu reaksi redoks sebagai berikut. aBr^ + b...
Indikator Titrasi Reduksi Oksidasi (Redoks) Titik akhir dari titrasi redoks dapat ditetapkan secara visual melalui reaksi redoks itu sendiri. Perubahan warna pada saat titik akhir tercapai dapat diketahui dengan penambahan indikator. Indikator merupakan senyawa organik yang dapat mengalami perubahan warna apabila terjadi perubahan biloks.

Diketahui persamaan reaksi redoks sebagai berikut.MnO4^
Redoks Redoks atau redox adalah istilah yang menjelaskan berubahnya bilangan oksidasi (keadaan oksidasi) atom-atom dalam sebuah reaksi kimia. Hal ini dapat berupa proses redoks yang sederhana seperti oksidasi karbon yang menghasilkan karbon dioksida, atau reduksi karbon oleh hidrogen menghasilkan metana (CH4), ataupun ia dapat berupa proses yang kompleks seperti oksidasi gula pada tubuh.

Diketahui persamaan reaksi redoks berikut aCr2O7^(2)
Reaksi redoks adalah reaksi kimia di mana reduksi dan oksidasi terjadi. Langkah pertama dalam menyelesaikan setiap reaksi redoks adalah menyetarakan persamaan redoks.. Soal Reaksi Redoks. Diketahui persamaan redoks setara berikut untuk reaksi antara MnO 4 -dan Fe 2+ dalam larutan asam: MnO 4 -(aq).

Diketahui reaksi redoks berikut. aCr2O7^(2)(aq)+14H^+(aq...
45+ Soal Penyetaraan Reaksi Redoks (Reduksi dan Oksidasi) [Update] Pada tahun 1774 seorang ilmuan bernama Joseph Priestley yang tercatat dalam sejarah melakukan penelitian terhadap oksigen di laboratorium dimana reaksi bersejarah ini juga merupakan reaksi oksidasi-reduksi. Priestley memanaskan merkuri oksida dan membentuk unsur merkuri dan oksigen.

Mempelajari Konsep Reaksi Redoks (ReduksiOksidasi) Kimia Kelas 10
Pemahaman Akhir. Reaksi redoks merupakan reaksi yang terdiri dari reduksi (penerimaan elektron) dan oksidasi (penyisihan elektron). Konsep reaksi redoks dapat dilihat dari berbagai sudut pandang, seperti berdasarkan pengikatan dan pelepasan oksigen, pengikatan dan pelepasan elektron, atau penambahan dan penurunan bilangan oksidasi.

Konsep Reaksi Redoks
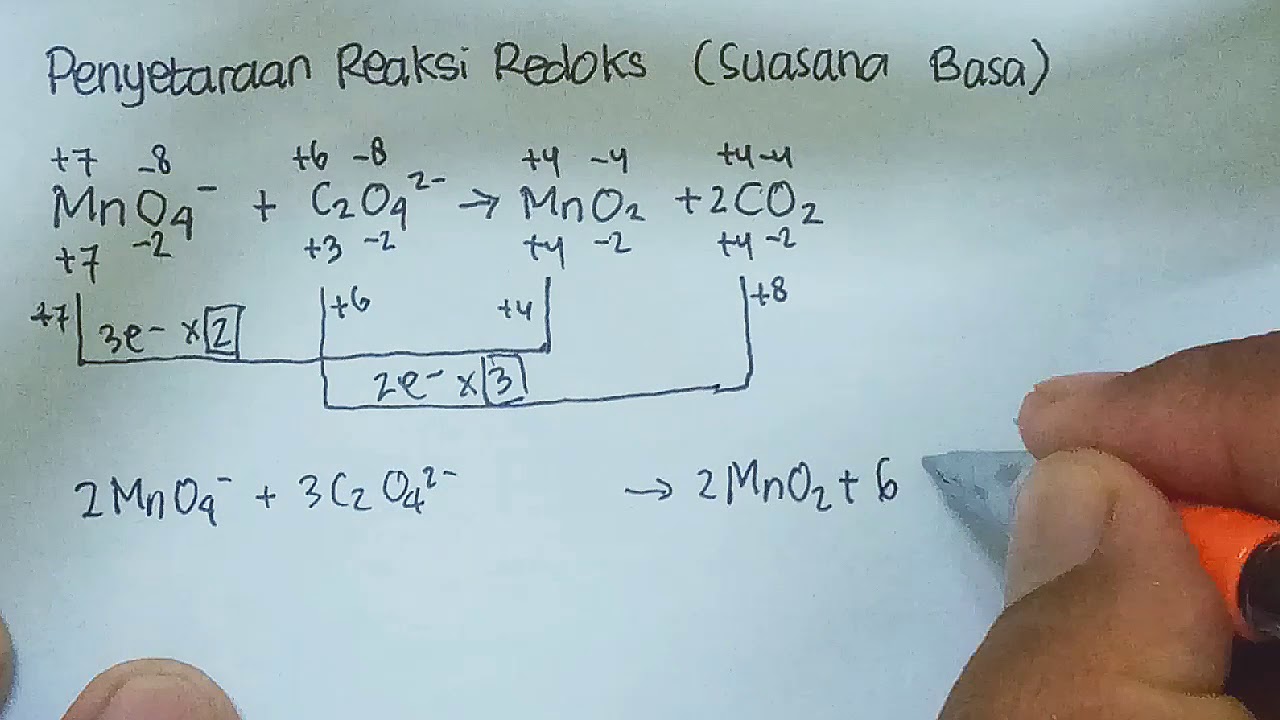
Reaksi autoredoks/disproporsionisasi merupakan reaksi redoks dimana satu zat mengalami reaksi reduksi dan oksidasi sekaligus. Contoh: S merupakan hasil reduksi sekaligus hasil oksidasi;. Diketahui persamaan reaksi redoks. KMnO 4 (aq) + KI(aq) + H 2 SO 4 (aq) → MnSO 4 (aq) + I 2 (aq) + K 2 SO 4 (aq) +H 2 O(l)
Contoh Soal Reaksi Redoks Dan Pembahasannya
Penerapan Reaksi Redoks dalam Kehidupan Sehari-Hari. Di awal artikel, gue sempet mention beberapa contoh, lalu bagaimana nih penerapan reaksi redoks dalam kehidupan sehari sehari. Nah, supaya elo gampang mengingat, gue udah buat daftar contohnya berikut ini: Pembakaran. Tahu nggak sih, oksigen yang ada di atmosfer bumi itu mengalami penurunan.

Diketahui reaksi redoks 3 FeCl2 (aq) + H2S (g) > 2 FeCl...
Remidi Kimia Kelas Xii.IPA. Redoks Approved & Edited by ProProfs Editorial Team The editorial team at ProProfs Quizzes consists of a select group of subject experts, trivia writers, and quiz masters who have authored over 10,000 quizzes taken by more than 100 million users.
Diketahui reaksi redoks berikut P(s) + NO[3] (aq)...
Proses redoks menjadi sumber utama energi dalam beragam proses biologis dan industri. Sebagai contoh, dalam proses metabolisme, oksidasi senyawa organik seperti glukosa menghasilkan energi yang digunakan oleh sel. Di sektor industri, reaksi redoks diterapkan dalam pembangkit listrik, seperti dalam sel bahan bakar. 3. Penggunaan Bahan Bakar.

Diketahui reaksireaksi redoks dalam industri berikut. (1...
Halo Koperasi di sini ada soal tentang penyetaraan reaksi redoks setengah reaksi oksidasi dari reaksi tersebut adalah yang mana Oke jadi di sini ada aturan bilangan oksidasi atau biloks yang pertama biloks unsur bebas akan sama dengan nol yang kedua jumlah dilaksanakan dalam yang sama dengan muatannya yang ketiga. Jumlah bilangan unsur-unsur.

Diketahui reaksi redoks berikut. Br2 (l) + KOH (aq...
Langkah 1: Setarakan jumlah atom yang terlibat dalam reaksi, kecuali atom O dan H. MnO + PbO 2 → MnO 4- + Pb 2+. Langkah 2: Menentukan bilangan oksidasi masing-masing atom dalam reaksi dan menentukan spesi yang mengalami oksidasi serta reduksi. MnO + PbO 2 → MnO 4- + Pb 2+. sumber: dokumentasi pribadi.
Contoh Reaksi Redoks Dalam Kehidupan Sehari Hari Beserta Reaksinya Berbagai Contoh
Reaksi redoks digunakan dalam berbagai metode analisis kimia, termasuk titrasi redoks, di mana konsentrasi suatu senyawa ditentukan berdasarkan reaksi redoks dengan senyawa standar yang telah diketahui konsentrasinya. 8. Industri Kimia.