
Firstwisnu Media Kenaikan Titik Didih Dan Penurunan Titik Beku Larutan Reverasite
Selisih titik beku pelarut (Tf o) dengan titik beku larutan (Tf) yang kemudian disebut penurunan titik beku (ΔTf). Berikut rumus penurunan titik beku: ΔTf = Tf° - Tf. Menurut Hukum Backman dan Raoult, penurunan titik beku dan kenaikan titik didih berbanding langsung dengan molalitas yang ikut terlarut di dalamnya.

Kenaikan Titik Didih Penurunan Titik Beku Sifat Koligatif Larutan Reverasite
Rumus untuk menentukan titik beku larutan adalah sebagai berikut. Karena nilai Kf pelarut sama, maka untuk membandingkan penurunan titik beku antar larutan dapat dilihat dari hasil konsentrasi dengan i (faktor van't hoff menggambarkan jumlah ion yang terdisosiasi). Semakin kecil , maka penurunan titik beku akan semakin rendah sehingga titik beku larutan akan menjadi paling besar jika.

Penurunan Titik Beku Larutan Dan Contoh Soal Faktasantuy Com My XXX Hot Girl
Penurunan titik beku adalah salah satu sifat koligatif larutan yang dipengaruhi oleh beberapa faktor. Faktor-faktor yang mempengaruhi penurunan titik beku meliputi: Konsentrasi Partikel Terlarut: Semakin tinggi konsentrasi partikel terlarut dalam larutan, semakin besar penurunan titik beku yang terjadi. Ini berarti larutan dengan konsentrasi.

Konsep Mudah Menentukan Titik Didih, Titik Beku Dan Tekanan Osmotik Larutan Elektrolit KIMIA
Hubungan antara titik beku larutan dan kemolalan ini dapat dituliskan pada rumus berikut ini.. Suatu larutan dibuat dengan cara melarutkan 3 gram urea. gram air. (K f air = 1,86 °C/m Ar C = 12, O = 16, N = 14, H = 1). Tentukan penurunan titik bekunya. Pembahasan. Sebelum mencari penurunan titik beku, kamu harus mencari nilai Mr dari CO.
Perhatikan bagan berikut Larutan yang mem...
Untuk larutan elektrolit menggunakan rumus: Keterangan: ∆T f = Penurunan titik beku. K f = Tetapan penurunan titik beku molal. n = Jumlah mol zat terlarut. p = Massa pelarut. i = Faktor Van't Hoff. Dalam bidang thermodinamika konstanta titik beku ( K f ) lebih dikenal dengan istilah "Konstanta Kriokopik".

Data percobaan penurunan titik beku Larutan Konsentrasi
KOMPAS.com - Berikut cara menghitung kenaikan titik didih dan penurunan titik beku pada larutan elektrolit, serta cara menentukan faltor van't hoff larutan elektrolit:. Soal: Sebanyak 8,7 gram potassium sulfat (K2SO4) dilarutkan kedalam 250 gram air.Maka, kenaikan titik didihnya adalah… 0,312 derajat celcius; 0,624 derajat celcius; 1,312 derajat celcius.

Cara Menghitung Tetapan Penurunan Titik Beku Larutan (Kf) (UN Kimia 2018 No. 24) YouTube
Tf0: titik beku pelarut murni Tf: titik beku larutan. Baca juga: Sifat Koligatif Larutan Elektrolit dan Faktor Vant Hoff . Dilansir dari Chemistry LibreTexts, penurunan titik beku bergantung pada jumlah total partikel terlarutnya. Sehingga, dapat dihitung melalui molalitasnya sebagai berikut: Dengan, ΔTf: penurunan titik beku m: molalitas.

Kenaikan Titik Didih Penurunan Titik Beku Sifat Koligatif Larutan Reverasite
Penurunan titik beku larutan encer sebanding dengan konsentrasi massanya. Oleh karena itu, untuk mengetahui cara menentukan tetapan titik beku dan menentukan berat molekul zat non volatil dilakukan percobaan "Penentuan Titik Beku Larutan" ini. 1.2 Tujuan Tujuan dari percobaan ini: 1. Menentukan tetapan penurunan titik beku molal pelarut 2.

Penurunan Titik Beku Larutan Definisi Dan Penyebabnya Reverasite
Sama halnya pada kenaikan titik didih, adanya zat terlarut dalam larutan mengakibatkan titik beku larutan menjadi lebih kecil daripada titik beku larutannya. Selisih antara titik beku pelarut dengan titik beku larutan disebut penurunan titik beku.. Cara menentukan titik beku larutan sebagai berikut: ΔTf = Kf . m ΔTf = Kf . gr. Mr. x . 1000.

Pengertian Titik Didih Larutan Dalam Ilmu Kimia LABORATORIUM SMK
Untuk dapat membandingkan titik didih beberapa zat, di bawah ini diberikan data titik didih larutan dan tetapannya (K b). Untuk menentukan nilai kenaikan titik didih larutan dapat digunakan persamaan sebagaimana penentuan penurunan titik beku larutan. Persamaan yang digunakan adalah: ∆Tb = Tb (larutan) - Tb (pelarut) ∆Tb = m . Kb. Dengan.

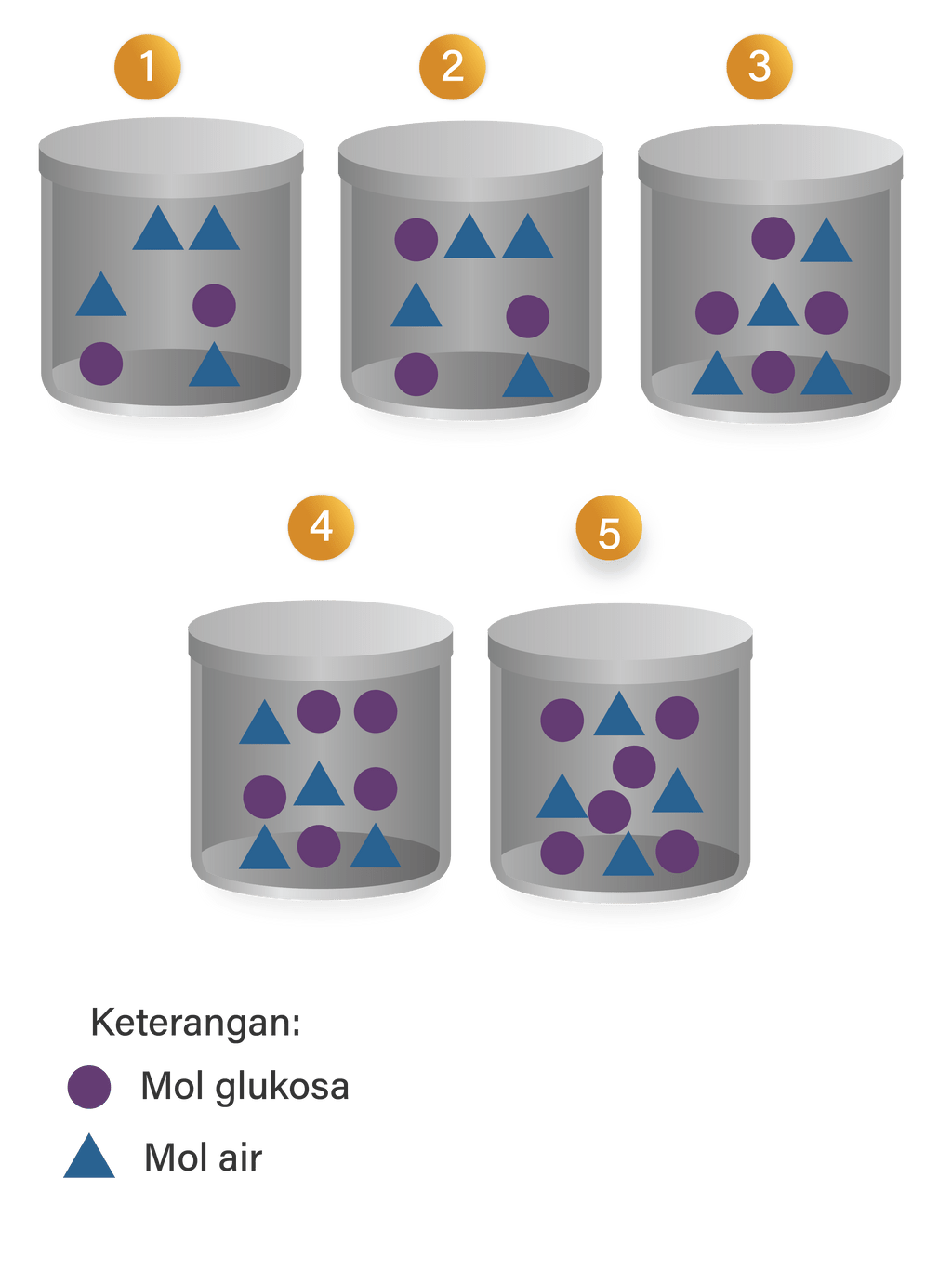
Larutan berikut yang memiliki titik beku paling tinggi ad...
tentukan titik didih dan titik beku larutan yang mengandung 18 gram glukosa , Mr 180 dalam 500 gram air. jika kb dan kf diketahui. sifat koligatif larutan..

Contoh Soal Titik Beku Larutan (Sifat Koligatif Larutan Elektrolit) YouTube
Titik beku larutan = 0 °C - 18,6 °C = -18,6 °C. Titik beku larutan 64 gram naftalena dalam 100 gram benzena adalah 2,91 °C. Jika titik beku benzena 5,46°C dan tetapan titik beku molal benzena 5,1 °C, maka tentukan massa molekul relatif naftalena! Jawab: ΔTf = m × Kf ΔTf = massa benzena/Mr x 1.000/p x Kf
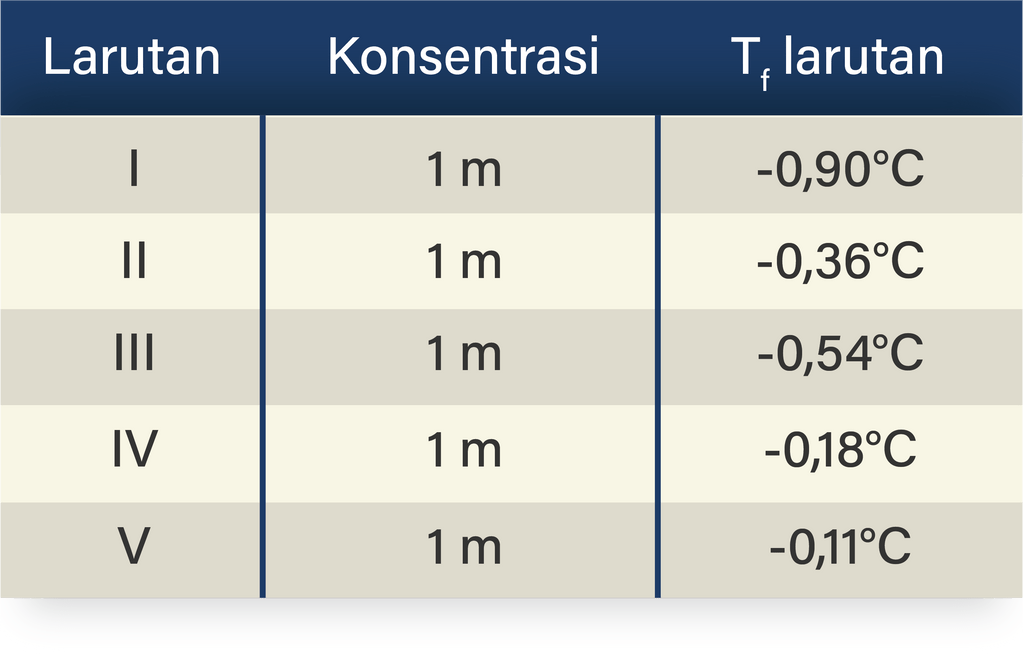
Berikut ini data titik beku beberapa larutan dalam...
Pengertian dan Rumus Penurunan Titik Beku Menurut Rananda Vinsiah dalam Fenomena Sifat Koligatif Larutan Kimia Kelas XII (2020, hlm. 19), titik beku merupakan kondisi ketika tekanan uap suatu cairan sama dengan tekanan padatannya. Pada kondisi seperti itu, cairan akan mulai membeku. Seandainya ada suatu zat terlarut yang dicampurkan ke pelarut murni, akan tercipta larutan baru.

Berikut disajikan data percobaan tentang titik beku beber...
Video ini berisi penjelasan tentang salah satu sifat koligatif larutan, yaitu penurunan titik beku. Untuk mempermudah pemahaman, video ini dilengkapi dengan.

Contoh Soal Perbandingan Penurunan Titik Beku (Sifat Koligatif Larutan Elektrolit) YouTube
Materi ini bertujuan untuk memahami proses penurunan titik beku larutan dengan menerangkan diagram fase larutan dan menghitung titik beku suatu larutan dg ca.

Rumus titik beku larutan
Pada percobaan pengujian titik beku larutan urea yang massanya sama dengan larutan NaCl, (11,7 g dalam 1 L larutan) ternyata menghasilkan titik beku yang ber.